糖尿病の治療薬
-第12回 ジェネリック医薬品-その1
ジェネリック医薬品とは
今回から糖尿病薬のジェネリック医薬品について、触れていってみたいと思います。
「ジェネリック医薬品」という言葉は、最近テレビCMや新聞などで見聞きするようになりましたが、まずは、ジェネリック医薬品について基本的な知識からお話しましょう。
ジェネリック医薬品とは、最初に厚生労働省に承認された新薬(先発医薬品といいます)の特許が切れた後に販売される、先発医薬品と同じ有効成分で、含量、用法・用量も同一であり、効能・効果、安全性等が同等な医薬品のことをいいます。ジェネリック医薬品は、先発医薬品に対して後発医薬品とも呼ばれています。
ジェネリック医薬品の「ジェネリック」とは、「一般名(generic name)」の“generic”が由来です。
医薬品には、「一般名」と「商品名」のふたつの呼び名があります。「一般名」とは、有効成分の名前のことで、同じ有効成分であれば同じ名前で呼ばれるのに対して、「商品名」は、製薬会社が販売するときの名前で、各社が思考を凝らして名前をつけています。
糖尿病治療薬のひとつであるα-グルコシダーゼ阻害薬(第5回コラム参照)を例にあげると、ボグリボースが一般名、ベイスン®錠が商品名です。
ジェネリック医薬品の普及が進んでいる欧米では、ジェネリック医薬品を商品名ではなく一般名(generic name)で処方される場合が多いため、それに習って、日本では後発医薬品のことを「ジェネリック医薬品」と呼ばれるようになったようです。
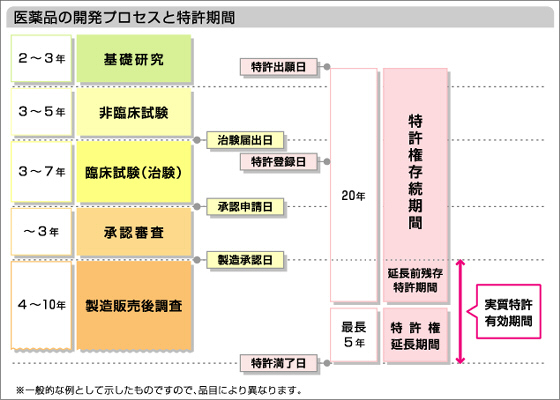
では、先発医薬品が世に出たら、すぐにジェネリック医薬品を製造販売できるかというとそうではありません。新薬にも発明を保護する権利である特許権があり、その特許が存続している期間中は、独占的に製造・販売できるように権利が保護されています。
これによって、新薬を開発した製薬会社は、その新薬開発に要した研究開発費用を回収でき、新薬で得られた利益によって新たな新薬の開発費用としても再投資できるという仕組みです。
日本の特許権の存続期間は、特許出願日から20年をもって満了するとされていますが、医薬品の場合は、新薬の製造販売の承認を得るまでに、安全性等を確保するための臨床試験(治験)の実施や規制当局(独立行政法人医薬品医療機器総合機構)の審査など、かなりの時間を要します。
これでは特許権の存続期間20年のうち、特許権を利用できる期間が短くなってしまうことがありますので、このような場合には延長が認められる特許権の存続期間の延長制度というものがあります。
治験届出日から製造承認日あるいは特許登録日から製造承認日のいずれか短い期間で、最長5年の延長が認められます。